КОМУ И КАК ПРОВОДИТСЯ ЛЕЧЕНИЕ МЕРЦАТЕЛЬНОЙ АРИТМИИ
Содержание
О МЕХАНИЗМЕ ВОЗНИКНОВЕНИЯ МЕРЦАТЕЛЬНОЙ АРИТМИИ
Из всех аритмий сердца лечение мерцательной аритмии, с целью восстановить правильный ритм сердца, требует кардинально различающихся по тактике схем лечения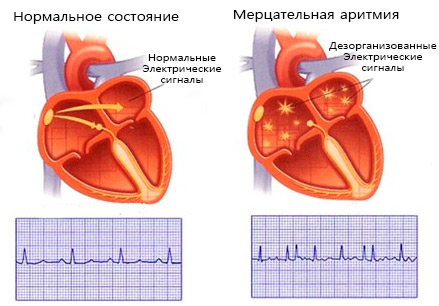 .
.
Сердце здорового человека состоит из четырех камер: двух предсердий и двух желудочков. Кровь из органов организма поступает в предсердия и после их сокращения перекачивается в желудочки. Из желудочков, после их сокращения, кровь попадает в большой и малый круг кровообращения и тем самым достигается снабжение кровью органов и тканей всего организма.
Считается нормой, если предсердия и желудочки сокращаются слаженно друг за другом и при этом частота ритма их сокращений не превышает 90 ударов в минуту. Когда же по какой-либо причине возникает мерцательная аритмия, то предсердия теряют ритм и начинают совершать сокращения хаотично в учащенном режиме с частотой до 600 вялых пульсаций в минуту. При этой мерцательной пульсации сердце не может активно перегонять кровь сквозь себя и доставлять ее к органам организма.
К сожалению, мерцательная аритмия является самым распространенным видом аритмий, от которой страдает более 0,5% населения нашей планеты. К тому же острота проблемы усугубляется не столько ростом числа заболеваний этим недугом, сколько тяжестью сопутствующих ему осложнений. Статистически подтверждено, что около 35% церебральных инсультов происходит из-за мерцательной аритмии. Опасность длительного приступа мерцательной аритмии в том, что кровь, застаиваясь, сгущается и превращается в тромб. При восстановлении ритма, сгусток тромба, попадая в головной мозг, в не самом подходящем случае приводит к инсульту, но это же может стать причиной летального исхода. Может случиться и так, что такой тромб попадет в артерию того или иного органа. Последствия чреваты инфарктом или некрозом соответствующего органа или ткани.
МЕРЦАТЕЛЬНАЯ АРИТМИЯ С ЕЕ СИМПТОМАМИ И ГРУППОЙ РИСКА
Самыми характерными симптомами, указывающими на появление у больного мерцательной аритмии, являются неритмичное сердцебиение, ком в горле, неритмичные толчки в груди, головокружение, затрудненность дыхания, одышка, слабость. Возможны скачки артериального давления, и даже потеря сознания.
В группу риска больных мерцательной аритмией чаще всего попадают люди с хронической сердечной недостаточностью (подробнее в статье «Когда лечение сердечной недостаточности во спасение») или клапанными пороками сердца. В группе риска, по вполне закономерной причине, мужчин в полтора раза больше, чем женщин. Этот факт объясняется тем, что пристрастие сильной половины к алкоголю, служит пусковым моментом к развитию мерцательной аритмии. Из опыта и наблюдений установлено, что у некоторых людей даже однократное употребление умеренной дозы алкоголя может спровоцировать развитие заболевания мерцательной аритмией.
Стабильно входят в группу риска пациенты с ишемической болезнью сердца, спортсмены, которые в погоне за высокими результатами привели свое сердце в болезненное состояние, больные с постинфарктными проблемами. Очень велика вероятность попадания в группу риска людей, страдающих сахарным диабетом и с хронически повышенным артериальным давлением.
ОФИЦИАЛЬНАЯ МЕДИЦИНА И МЕРЦАТЕЛЬНАЯ АРИТМИЯ
Так как встречается несколько форм мерцательной аритмии, то и тактика их лечения, естественно, для каждого случая будет иной.
Если у человека в основном сердечный ритм правильный и только время от времени его беспокоит пароксизмальная, то есть приступообразная, форма мерцательной аритмии, то от таких приступов больной может вполне избавиться или самостоятельно, или же с помощью врача. До недавнего времени считалось, что эта приступообразная форма мерцательной аритмии не требует лечения.
Но, когда аритмия постоянная и она сопровождает больного беспрерывно и неотступно, то в этом случае, вопреки желанию больного, врач убеждает его смириться с тем, что невозможно восстановить нормальный ритм сердца. Больной должен понять, что его спасение в сокращении частоты сердечных сокращений до приемлемо возможного уровня. Не обязательно снижать до нормы в 55 — 60 ударов в минуту. Снижать необходимо к достаточно близким цифрам указанной нормы и ориентироваться при этом на появление ощущения относительной комфортности в самочувствии. Для снижения частоты пульса близкой к норме хорошо себя зарекомендовал препарат конкор. По частоте пульса доза конкора может быть от 5 до 10 мг один раз в сутки. Но если с указанной дозой конкора пульс все же не удается снизить, как можно ближе к норме, то лечение дополняется половинкой 0,25 мг таблетки дигоксина. Указанных доз бывает достаточно, чтобы нормализовать комфортность самочувствия.
Так как опасность мерцательной аритмии в том, что могут образовываться тромбы, то во избежание мозговых инсультов следует принимать аспирин по четверти таблетки в день или же такие его специальные формы, как тромбоАСС, карди — АСК.
Лечение приступообразной формы мерцательной аритмии тогда эффективно, когда по результатам ультразвукового исследования становятся известны параметры левого предсердия. Если это предсердие окажется растянутым более чем на 4 сантиметра, то именно оно вероятней всего является причиной мерцательной аритмии. При возникновении очередного приступа тактика лечения сводится не к восстановлению ритма до нормы, а к снижению частоты пульса по схеме, которая была изложена выше, только что.
Если же левое предсердие не растянуто и угроза срыва ритма недостаточно велика, то схема лечения принимается несколько иной. В этом случае больные обязаны принимать препараты, способные предупредить аритмию. Обычно это кордарон, принимаемый сначала в дозировках по 600 или даже 1200 мг в сутки, а потом постепенно перейти на одну таблетку в 200 мг с частотой 5 раз в неделю.
Очень эффективен в предупреждении аритмии препарат соталекс, который принимают за 1 — 2 часа до еды. В первые дни лечение начинают с дозы 160 мг в день в 2 приема (ориентировочно через 12 часов). Выбранную эту дозу при необходимости можно уменьшить или увеличить в зависимости от состояния больного.
К немедикаментозным способам лечения мерцательной аритмии относится метод так называемой радиочастотной аблации. При этом бывает достаточно изолировать очаг мерцательной аритмии, чтобы избавить пациента от появления приступов. Этот метод лечения позволяет избавить больного от мерцательной аритмии на долгие годы.
Из средств народной медицины, как вспомогательное средство, при лечении мерцательной аритмии, очень полезны сборы с боярышником. Более подробно о рецептах в сборах с боярышником в моей статье «Боярышник и здоровье».
В заключение напоминаю о том, что необходимо вести здоровый образ жизни и не поддаваться соблазну того алкоголя, который может спровоцировать мерцательную аритмию.
Всем здоровья и успехов в каждом начинании!

Теория Ермошкина В.И. о причине аритмии сердца
Медицинская статистика по смертности населения от сердечно сосудистых заболеваний очень печальная. Причин высокой смертности несколько, а некоторые проблемы, например проблема разгадки механизма аритмии, казались неприступными, несмотря на 105-летний поиск причин заболеваний сердца с использованием ЭКГ и многих других физических методов.
До моей гипотезы «Тайна зубца U на ЭКГ» (2011г) природа зубца U была неизвестна. Вернее, было несколько гипотез, без значимых для медицины выводов. Считалось, что правильная работа сердца в основном зависит от водителя ритма и проводящей системы сердца. Из-за малой амплитуды зубца U и из-за менее 50% отчетливой наблюдаемости у людей, зубец U при анализе ЭКГ официальная медицина в своих методических указаниях выбросила из рассмотрения и не достаточно обращала на него внимания. Но в моей гипотезе сделана попытка показать, что малый зубец U при превышении некоторого относительно малого порога (у каждого индивидуума свой, изменяющийся во времени) может превращаться в экстрасистолу (ЭС), а в некоторых случаях приводить к патологической тахикардии с постепенными повреждениями сердечно сосудистой системы (ССС) человека.
Какова природа зубца U? Оказалось, что это собственный патологический пульс, прошедший по одному из контуру сосудов «артерии-естественные шунты-вены», достигает предсердий и генерирует либо зубец U, либо ЭС. Обычно мембранный потенциал покоя кардиомиоцитов равен минимальному уровню -90…-80 мВ. (Здесь и ниже по тексту: – меньше, + больше, несмотря на абсолютную величину потенциала в мВ.) Если механическая волна (импульс растяжения и последующего сжатия ткани) любого происхождения достигает предсердий, потенциал покоя мембран кардиомиоцитов повышается. Можно предположить, что потенциал покоя мембран кардиомиоцитов может модулироваться амплитудой механических напряжений ткани, например, патологическим пульсом. Тем более ранее было показано, что, например, из-за гипертонии, из-за постоянного избыточного механического растяжения миокарда может возникать его гипертрофия. Гипертрофия миокарда приводит к постоянной «утечке» ионного тока, что в свою очередь влияет на увеличение потенциала покоя, например, до уровней -80…-70 мВ, что может приводить к сердечной недостаточности. Если колебания потенциала клеток находится ниже порога действия, то возникают только зубцы U, если выше, например, в диапазоне -60…-30, то экстрасистолы. Пороговый потенциал активации кардиомиоцитов обычно равен -70…-60 мВ. Можно положить, что у людей, склонных к ССЗ, пороговый потенциал выше (ближе к -60), а у здоровых ниже (около -70), поэтому разность мембранных потенциалов (и мощность единичных прокачек) при деполяризации клеток миокарда у больных меньше (80…100 мВ), чем у здоровых (110…120 мВ).
Главный вопрос, как и почему пульс попадает на предсердия? Оказалось, из-за повышенного тонуса крупных сосудов, вызванного стрессами, чрезмерными физическими нагрузками, гипертонией, частичным склерозом сосудов. Ведь по сосудам с повышенной жёсткостью пульс бежит как по своеобразному волноводу, с меньшим затуханием и с большей скоростью, а увеличение скорости может приводить к смещению зубца U влево. У человека с мягкими сосудами «задержка» зубца U, если он начинает фиксироваться на ЭКГ, видимо, больше одного интервала QQ.
Вот что говорит о зубце U официальная медицина: «При вдохе зубец U бывает короче и выше, чем при выдохе. Этот зубец бывает часто особенно отчетливым (до 2.5 мм) у молодых лиц, в особенности у спортсменов». На естественный вопрос «Почему именно так?», ответа пока не было. А ведь ответ с точки зрения моей теории лежит на поверхности: при вдохе увеличивается давление и тонус сосудов, пульс по таким сосудам затухает меньше, а скорость перемещения выше. То же самое происходит и при повышенных нагрузках у молодых лиц и у спортсменов.
В итоге у обычного человека патологический процесс заболевания ССС надвигается с двух сторон: сосуды становятся более жёсткими, более легко проводящими пульс, а с другой стороны кардиомиоциты в сердце из-за гипертрофии не могут достичь нормального потенциала покоя, чтобы быстро «зарядиться» и чтобы «отдохнуть» во время диастолы. Развиваются миокардит, кардиомиопатия, преобладание соединительной ткани в миокарде, недостаточность, сердце не может работать на полную мощь.
Почему у организма нет защиты от прохождения пульса на сердце? Это не так. У здорового человека с нормальным артериальным давлением и «мягкими» сосудами пульс затухает в капиллярном русле, вероятность возникновения аритмических проблем с сердцем мала, кроме того, «задержка» пульса, попадающего на предсердия, видимо, более одного интервала RR. После начала развития гипертонии защита тоже есть, но не очень эффективная: как правило, у человека от внеочередных «неправильных» ударов сердца формируется сильный испуг, это приводит к изменению тонуса сосудов и смещению зубца U на ЭКГ, и если повезёт, к смещению его в рефрактерную зону. У пожилых людей из-за артериосклероза диапазон регулировки сосудов очень узкий, и проблемы ЭС решаются очень трудно. Мною ещё в 2011г для борьбы с аритмиями был предложен метод круговой механической изоляции лёгочных и полых вен и, возможно, некоторых артерий.
Т.о. коренной причиной аритмии являются длительные периоды повышения артериального давления и ремоделирование ССС. С гипертонией начинается рост анастомозов, расширение предсердий, увеличение вероятности ЭС из-за любых «встрясок», нервных или механических, расширение сосудов и появление бляшек, рост и открытие шунтов, соединяющих артериальное и венозное русла, повышение потенциала покоя мембран кардиомицитов до критического порогового уровня, при этом потенциал действия клеток при деполяризации уменьшается.
В периоды, когда начинают работать шунты, т.е. когда по ним начинает бесполезно протекать обогащенная кислородом алая кровь в крупные вены (не доходя до капилляров), то для обычного артериального пульса открывается возможность пробега по одному или нескольким контурам сосудов: по артериям, по открытым шунтам, например, кишечника, печени или других внутренних органов, далее по наполненным кровью венам и достигать правого предсердия. Аналогичные перестройки-ремоделирования происходят и в малом круге кровообращения, т.е. в легочных сосудах, с той лишь разницей, что пульс по легочным венам может попадать на левое предсердие. Подчеркну, что пульс и скорость пульса, это не одно и то же, что движение крови по сосудам и скорость течения крови.
Гипотеза состоит в том, что этот патологический пульс, т.е. механические импульсы с помощью механо-электрической связи в предсердиях (вены не обладают механо-электрической эффектом), увеличивают потенциал покоя и могут при превышении порога запускать внеочередные удары, т.е. ЭС.
Интересно то, что медицина испокон веков пользовалась импульсным увеличением потенциала покоя для запуска ЭС, т.е. для аварийного запуска сердца очень часто, например, прекардиальным ударом, но теоретически осмыслить его значение, даже при наличии ЭКГ, к сожалению, не смогла. По современным оценкам эффективность прекардиального удара при внезапных остановках сердца, но в течение первой минуты после начала приступа, достигает 70%!
При попадании патологического пульса в 50% или 33% точку развертки ЭКГ, т.е. интервала QQ, по законам физики может возникнуть механический резонанс частот от «водителя ритма» и «собственных частот» различных контуров сосудов, проводящих патологический пульс, и далее может возникнуть патологическая тахикардия с всегда внезапным началом и внезапном прекращением — именно такой почерк механического резонанса в природе. Ещё одним условием возникновения резонанса сосудов является длительность рефрактерной зоны, т.е. длительность интервала QT. Последний должен быть «согласован» с 50% или 33% интервалом QQ, т.е. быть меньше этих величин.
При попадании зубца U в 50% точку развертки QQ возникает патологическая тахикардия на частотах близких к 2*F=140 удмин, в 33% точку — на частотах 3*F=210 удмин. Здесь F- средняя ЧСС у людей, равная примерно 70 удмин. Однажды начавшись, патологическая тахикардия некоторое время сама себя и поддерживает, блокируя импульсы от водителя ритма. Характерной особенностью такой тахикардии является постоянный интервал времени между ударами, что объясняется одинаковым временем пробега пульса по одним и тем же сосудам, а не таинственным интервалом времени «re-entry» вращения импульса возбуждения внутри миокарда по замысловатым «траекториям» с «быстрыми» или «медленными» проведениями.
По доступным в интернете ЭКГ мною была построена гистограмма распределения ЧСС у группы больных с патологической тахикардией. Количество ЭКГ равнялось 133. Гистограмма имела два четких максимума на частотах 140 и 210 удмин, т.е. она приобретала резонансный вид с характерным минимумом на частотах 180-200 удмин. Это значит, что достоверно существуют режимы работы сердца, отличные от синусового. Это значит, что в диапазоне 180-200 удмин (по более точным данным в диапазоне 175-195) патологическая тахикардия наблюдается очень редко, а чаще всего остаётся «привязанной» к опорным точкам 140 и 210 удмин — в 46.6 %, и в 21.8 %, соответственно. По-видимому, патологическую тахикардию с ЧСС близкой к 140 удмин можно причислить к «предсердной», а с ЧСС около 210 удмин – к «желудочковой».
По данным, приведённым в медицинской литературе, чаще всего ЧСС при предсердной тахикардии равна 120-150 удмин (2*F=2*(60-75)). В работе [Bardy G, et al., 1984] проведена оценка средней желудочковой тахикардии, и она оказалась равной 207 удмин (3*69=3*F). Это значит, что среднее значение частоты импульсов, задаваемых водителем ритма, у больных с такой аритмией была 69 удмин (1*F), что практически совпадает с моими расчетами.
Можно предположить, что теория «re-entry», как она трактуется официальной медициной, видимо, не верна. Верно только то, что перемещения и модуляция амплитуд потенциалов в «эктопических очагах» на предсердиях есть вторичный феномен, первичным феноменом является переменные механические напряжения создаваемые патологическим пульсом в устьях вен, в тканях предсердий и всего миокарда. Далее сигнал от механического возбуждения, видимо, распространяется по, так называемым, скрытым аномальным путям проведения, дополнительным путям, по пучкам Кента и по другим, пока ещё недостаточно исследованным, специальным нервным волокнам, либо просто «пробегает» от клетке к клетке вместе с механическом возбуждением. В итоге деполяризация клеток миокарда при таком возбуждении происходит более медленно и не в оптимальной последовательности по сравнению с возбуждением от водителя ритма. Здесь нужны исследования.
Главное в рассматриваемой гипотезе, это то, что мною сделан предварительный вывод о том, что сокращения сердца могут запускаться и водителем ритма, и патологическим пульсом. Для этого в миокарде, видимо, есть две «конкурирующих» между собой, эволюционно закрепленных «проводящих систем». У здорового человека, конечно, доминирует синусовый водитель ритма, а у больного, особенно в минуты приступов, работает запуск ритма от патологического пульса, т.е. от механического возбуждения. В некоторых случаях перерезка пучка Кента приводит к ликвидации некоторых видов аритмии, но при этом, видимо, уменьшается или даже теряется возможность перезапуска сердечной деятельности с помощью прекардиального удара.
На практике иногда нормальные QRS чередуются с расширенными QRS, вызванными пульсом. При этом на ЭКГ мы видим именно суперпозицию двух «управляющих» работой сердца систем: от водителя ритма и от патологического пульса. В последнем случае могут наблюдаться «ложные» сердечные блокады главной проводящей системы, т.к. «проводящая система» от механического пульса блокирует основную систему, и «заставляет» импульс возбуждения идти якобы в «ретроградном» направлении.
Ещё один красноречивый факт в пользу новой теории. Академическая медицина вот уже более 60 лет не может объяснить, почему взрослые люди малого роста на 50% чаще страдают ССЗ. Проведено более 52 исследований в разных странах с участием трех миллионов человек, но объяснения не было. Однако, с точки зрения новой теории этот феномен становится понятным. Люди малого роста имеют также пропорционально меньшие длины всех одноименных сосудов: артерий и вен. Можно предположить, что ЧСС и интервалы QT, PQ на ЭКГ у всех людей практически одинаковы и слабо зависят от роста. В результате у людей малого роста с «короткими» сосудами вероятность попадания зубца U в интервал диастолы TQ на ЭКГ увеличится, начиная с более молодого возраста. Для мужчин критическим порогом «заболеваемости» является рост менее 165 см, а для женщин менее 153 см. Кроме того, есть ещё один фактор. Сбросить давление от 130 мм рт. ст.(аорта) до 60-70 (на входе артериол миокарда) при «коротких» коронарных сосудах значительно трудней, чем на нормальных, поэтому могут появляться дополнительные изгибы и сужения сосудов, анастомозы, ранний склероз и бляшки.
Вместе со стажем аритмии процесс разрушения ССС идет в одну и ту же сторону, а заканчивается жизнь зачастую трепетаниями и фибрилляциями. Остановить процесс проникновения пульса на предсердия можно только понижением давления крови, правильным образом жизни или с помощью механической изоляции предсердий от полых и легочных вен. К аналогичному выводу, но без строгой теории, пришли кардиохирурги после 15-20 летней практики РЧА эктопических очагов. Метод изоляции вен, как обязательная процедура, нашёл своё отражение в международных и российских медицинских Рекомендациях РКО, ВНОА, АССХ от 2012 и 2013 г, т.е. совсем недавно. Старую идею прижигания эктопических очагов на предсердиях наконец-то сняли (как бесполезную или даже вредную?!). Рекомендуют изолировать только устья вен, если нет других патологий. Правда, в упомянутом коллективном труде, рожденном методом проб и ошибок, по «старинке» говорится об «электрической» изоляции вен с помощью РЧА, т.е. посредством прижигания живой ткани миокарда в устьях вен. Чтобы идея моей гипотезы приобрела полную «доказанность», осталось лишь подождать, когда произойдет замена одного слова в Рекомендациях: вместо «электрической изоляции устьев вен» начнут говорить и писать о «механической изоляции вен».
В каких сосудах и где конкретно производить механическую изоляцию вен у конкретного индивидуума – вопрос открытый, возможны варианты, например, в шунтах, по которым пробегает патологический пульс. Но первое, что необходимо проделать уже сейчас, это проведение специальных экспериментов по подтверждению новой теории, переосмысливание некоторых глав кардиологии и аритмологии.
Ермошкин Владимир Иванович, evlad48@list.ru
AyboDal, нами опубликовано несколько статей на тему тяжёлых последствий от алкоголя. Поэтому полностью разделяем Вашу озабоченность, высказанную столь убедительно, в отзыве.
ZavgarNob, уважаемый завгар, о чём это Вы?